Principio de incertidumbre de Heisenberg
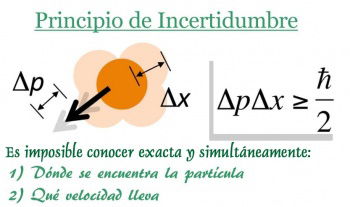
La relación de indeterminación de Heisenberg o principio de incertidumbre establece la imposibilidad de que determinados pares de magnitudes físicas observables y complementarias sean conocidas con precisión arbitraria. Sucintamente, afirma que no se puede determinar, en términos de la física cuántica, simultáneamente y con precisión arbitraria, ciertos pares de variables físicas, como son, la posición y el momento lineal de un objeto dado.
En otras palabras, cuanta mayor certeza se busca en determinar la posición de una partícula, menos se conoce su momento lineal y, por tanto, su masa y velocidad. Este principio fue enunciado por el físico y filósofo alemán Werner Heisenberg, lo que le valió el Premio Nobel de física
La explicación divulgativa del principio de incertidumbre afirma que las variables dinámicas como momento angular, momento lineal, etc. se definen de manera operacional, esto es, en términos relativos al procedimiento experimental por medio del cual son medidas: la posición se definirá con respecto a un sistema de referencia determinado, definiendo el instrumento de medida empleado y el modo en que tal instrumento se usa.
Sin embargo, cuando se examinan los procedimientos experimentales por medio de los cuales podrían medirse tales variables resulta que la medida siempre acabará perturbada. En efecto, si por ejemplo pensamos en lo que sería la medida de la posición y velocidad de un electrón, para realizar la medida es necesario que un fotón de luz choque con el electrón, con lo cual está modificando su posición y velocidad; es decir, por el mismo hecho de realizar la medida, el experimentador modifica los datos de algún modo, introduciendo un error que es imposible de reducir a cero, por muy perfectos que sean nuestros instrumentos.
Esta descripción cualitativa del principio, sin ser totalmente incorrecta, es engañosa ya que omite el principal aspecto del principio de incertidumbre que establece el límite de aplicabilidad de la física clásica
En definitiva, resumiendo el principio de incertidumbre de Heisenberg: no se puede determi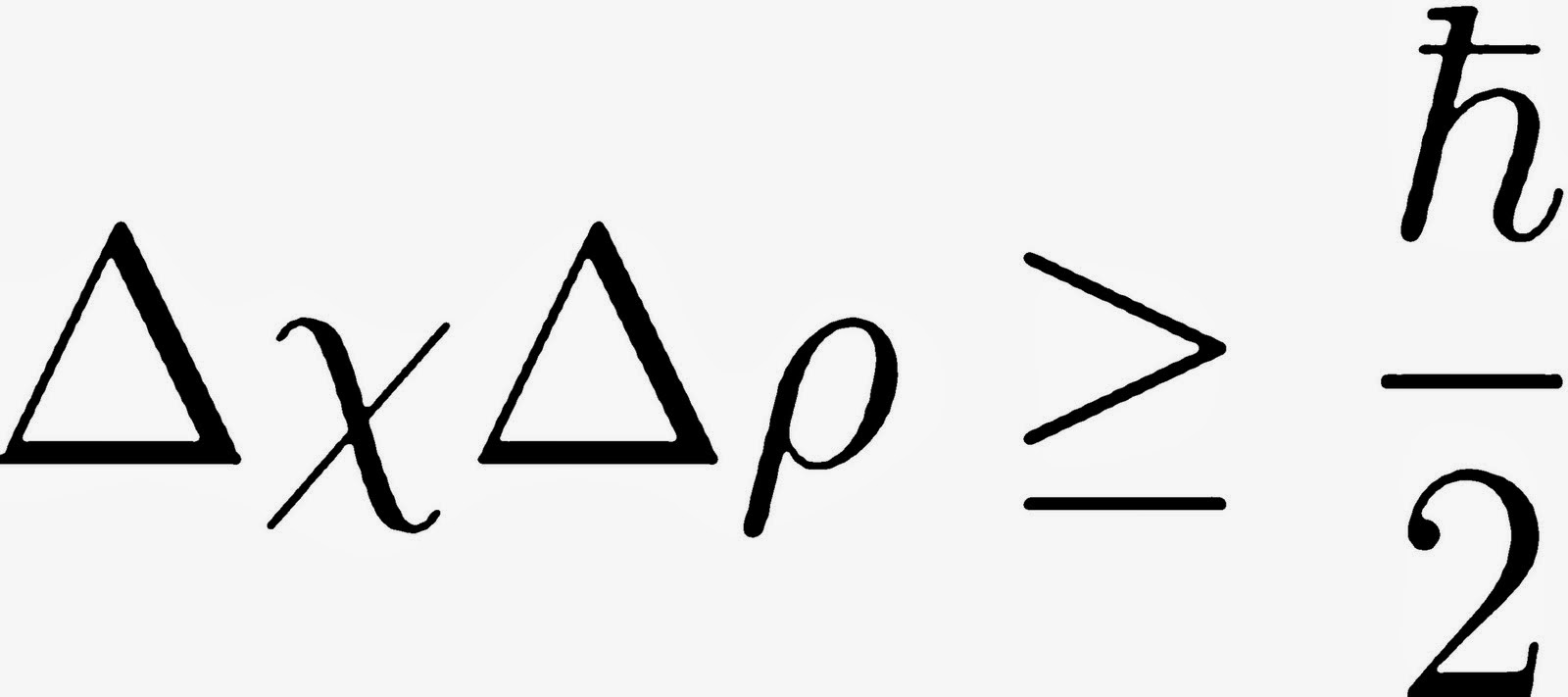
nar con total precisión la posición y la velocidad de una partícula simultáneamente. Por esto, a mayor conocimiento en la posición, mayor incertidumbre en la velocidad y viceversa.



